
Geometría Molecular I
La geometría tridimensional de las moléculas está determinada por la orientación relativa de sus enlaces covalentes. En 1957 el químico canadiense Ron Gillespie basándose en trabajos previos de Nyholm desarrolló una herramienta muy simple y sólida para predecir la geometría (forma) de las moléculas.
La teoría por él desarrollada recibe el nombre Teoría de Repulsión de los Pares de Electrones de Valencia (TRPEV) y se basa en el simple argumento de que los grupos de electrones se repelerán unos con otros y la forma que adopta la molécula será aquella en la que la repulsión entre los grupos de electrones sea mínima.
Para la TRPEV grupos de electrones pueden ser:
-
un simple enlace
-
un doble enlace
-
un triple enlace
-
un par de electrones no enlazante
Para predecir la geometría de una molécula necesitamos conocer solamente cuantos grupos de electrones están asociados al átomo central para lo cual debemos escribir la fórmula de Lewis de la molécula.
Luego simplemente nos preguntamos cómo los grupos de electrones se distribuirán espacialmente de modo que la repulsión entre ellos sea mínima.
Es importante recordar que la geometría de la molécula quedará determinada solamente por la distribución espacial de los enlaces presentes y no por la posición de los pares electrónicos no enlazantes, los que si deberán ser tenidos en cuenta en el momento de determinar la disposición espacial de todos los grupos electrónicos, sean enlaces o no.
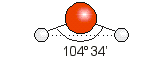
Por ejemplo la molécula de H2S tiene la siguiente fórmula de Lewis:
En ella podemos identificar 4 grupos de electrones: dos enlaces simples y dos pares de electrones no enlazantes.
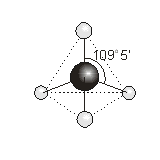
Para minimizar las repulsiones entre ellos adoptarán una geometría tetraédrica, colocándose cada grupo en el vértice de un tetraedro que tiene como centro al átomo de azufre. Sin embargo a la hora de determinar la geometría de la molécula, la misma sólo queda determinada por la distribución de los enlaces, por lo que la geometría del H2S será angular.
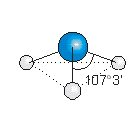
Note que el ángulo HSH es menor que 109.5°, el ángulo de un tetraedro regular. Esto se debe a la mayor repulsión generada por el mayor volumen de los pares de electrones no enlazantes.
En la siguiente tabla se muestra un ejemplo un compuesto, la estructura de Lewis, el enlace que forma y la forma Geometrica que adopta cada una.
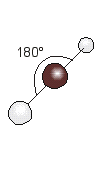
CO2
El CO2 es una molécula donde los dos átomos de oxígeno están ligados a un átomo central de carbono.
La estructura de Lewis de esta molécula es:
Para que los pares de electrones del átomo central estén lo más apartados posible, los pares ligantes correspondientes a los dos dobles enlaces, y por lo tanto los dos átomos de oxígeno, están en posiciones opuestas.
Esta molécula tiene, por lo tanto geometría lineal (ángulo O – C – O = 180°).
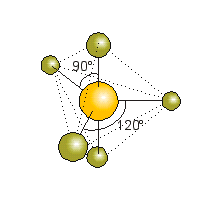
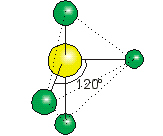
BCl3
El BCl3 es una molécula donde los tres átomos de cloro están ligados a un átomo central de boro.
La estructura de Lewis es:
Para que la repulsión electrónica sea la menor posible, la molécula adopta un arreglo de triángulo equilátero con el átomo de boro en el centro y los átomos de cloro en los vértices.
Esta molécula tiene geometría trigonal plana
(ángulo Cl – B – Cl = 120°)
SO2
El SO2 es una molécula donde los dos átomos de oxígeno están ligados a un átomo central de azufre.
La estructura de Lewis es:
El mayor apartamiento entre los pares de electrones correspondientes al doble enlace y al par de electrones no enlazante del átomo central corresponden a un arreglo triangular. Dos de las posiciones del triángulo son ocupadas por átomos de oxígeno , y la molécula tiene una geometría angular, formando un ángulo O-S-O menor que 120°
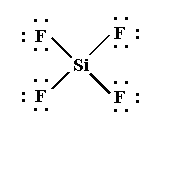
SiF4
El tetrafluoruro de silicio es una molécula donde los cuatro átomos de flúor están ligados a un átomo central de silicio.
La estructura de Lewis es:
Para que los cuatro pares de electrones del átomo central estén lo más apartados posible, el arreglo de éstos es tetraédrico.
Las cuatro posiciones del tetraedro están ocupadas por flúor y la molécula tiene geometría tetraédrica(ángulo F–Si – F= 109.5°)
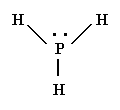
PH3
La fosfina es una molécula donde los tres átomos de hidrógeno están ligados a un átomo central de fósforo.
La estructura de Lewis es:
Para que los cuatro pares de electrones del átomo central estén lo más alejados posible, el arreglo de éstos es tetraédrico. Tres de las posiciones del tetraedro están ocupadas por hidrógeno y la geometría de la molécula es pirámide trigonal (ángulo H–P – H < 109.5°)
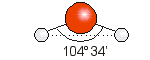
H2S
El sulfuro de hidrógeno es una molécula donde los dos átomos de hidrógeno están unidos a un átomo central de azufre.
La estructura de Lewis es:
Para que los cuatro pares de electrones del átomo central estén lo más alejados posible, el arreglo de éstos es semejante a un tetraedro. Dos posicionen del tetraedro están ocupadas por átomos de hidrógeno, y la molécula tiene geometría angular (ángulo H– S – H < 109.5°)
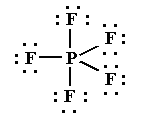
PF5
El pentafluoruro de fósforo es una molécula donde los cinco átomos de flúor están enlazados a un átomo central de fósforo.
La estructura de Lewis es:
Para que los pares de electrones del átomo central estén lo más separados posible, la geometría de la molécula es bipirámide trigonal.
SCl4
El tetracloruro de azufre es una molécula donde los átomos de cloro están unidos al átomo central de azufre.
La estructura de Lewis es:
Para que los cinco pares de electrones del átomo central estén lo más separados posible, el arreglo de éstos es semejante a una bipirámide trigonal, donde cuatro posiciones están ocupadas por átomos de silicio.
La geometría de la molécula es : balancín
IF3
EL trifluoruro de iodo es una molécula en la que los tres átomos de flúor están unidos al átomo central de iodo.
La estructura de Lewis es:
Para que los cinco pares de electrones del átomo central estén lo más separados posible, el arreglo de éstos es semejante a una bipirámide trigonal, donde tres posiciones están ocupadas por átomos de flúor.
La geometría de la molécula es en forma "T"
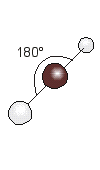
XeF2
El di fluoruro de xenón es una molécula donde los dos átomos de flúor están unidos a un átomo central de xenón.
La estructura de Lewis es:
Para que los cinco pares de electrones del átomo central estén lo más separados posible, el arreglo de éstos es semejante a una bipirámide trigonal, donde dos posiciones están ocupadas por átomos de flúor.
La geometría de la molécula es lineal
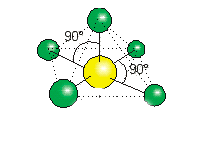
En el SiF6-2 los seis átomos de flúor están unidos a un átomo central de silicio. La estructura de Lewis es:
Para que los seis pares de electrones del átomo central estén lo más distanciados posible, el ordenamiento de estos es semejante a un octaedro, donde las seis posiciones están ocupadas por átomos de flúor.
La geometría de la molécula es octaédrica
IF5
En el IF5 los cinco átomos de flúor están unidos a un átomo central de silicio.
La estructura de Lewis es:
Para que los seis pares de electrones del átomo central estén lo más distanciados posible, el ordenamiento de estos es semejante a un octaedro, donde cinco posiciones están ocupadas por átomos de flúor.
La geometría es pirámide de base cuadrada.
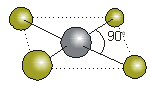
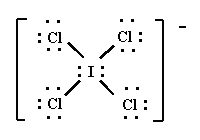
ICl4-
El ICl4- es una molécula en la que el átomo central de iodo está enlazado a cuatro átomos de cloro.
La estructura de Lewis es:
La geometría de la molécula es cuadrada plana
Para lograr una mejor visualización le recomendamos que visites este enlace
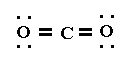

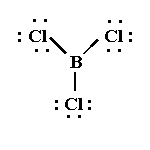


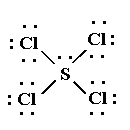
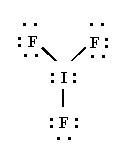
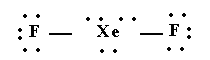

Geometría Molecular II:

CONTINUANDO CON EL ESTUDIO DEL TEMA DE GEOMETRÍA MOLECULAR ENTREMOS AL SIGUIENTE LINK
y analicemos cada una de las moléculas con sus formas Geométricas en 3D.
